Zgodnie z zaleceniami Światowej Organizacji Zdrowia (WHO) do diagnostyki COVID-19 stosuje się testy amplifikacji kwasów nukleinowych (ang. nucleic acid amplification tests, NAAT), w tym RT-PCR. Badania wykrywające specyficzne przeciwciała anty-SARS-CoV-2 mogą być stosowane jako dodatkowe narzędzie diagnostyczne w późniejszej fazie zakażenia SARS-CoV-2, stanowiąc idealne dopełnienie metody RT-PCR i wydłużając czas umożliwiający przeprowadzenie wiarygodnej diagnostyki COVID-19 [1] [2].
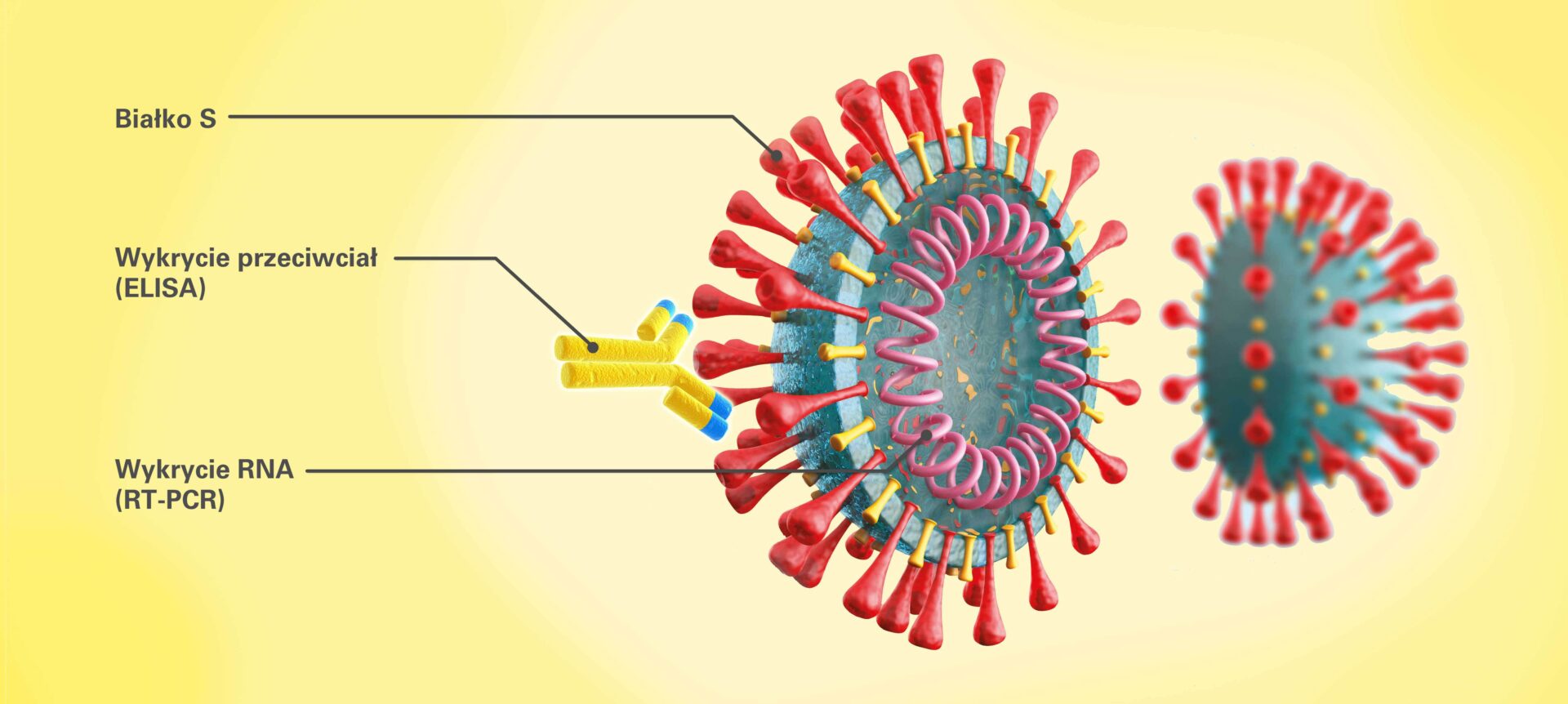
Unikalny antygen zastosowany w teście EUROIMMUN Anty-SARS-CoV-2 ELISA
Przy wyborze testu serologicznego do diagnostyki zakażeń koronawirusem SARS-CoV-2 należy zwrócić uwagę na zastosowany antygen, ponieważ determinuje on czułość i specyficzność badania.
Koronawirusy zbudowane są z czterech białek strukturalnych, ale wyłącznie białka S oraz N posiadają właściwości immunomodulujące [3]. Analiza genomu SARS-CoV-2 wykazała, że podjednostka S1 białka S SARS-CoV-2 cechuje się najniższą homologią z analogicznymi regionami innych patogennych dla człowieka koronawirusów. Wynika z niej, że pełnej długości białka N oraz S i podjednostka S2 białka S są regionami konserwatywnymi. Może to powodować wysoki odsetek reakcji krzyżowych w testach serologicznych [5]. Szczegółowe dane dotyczące homologii immunogennych białek strukturalnych w obrębie chorobotwórczych dla człowieka koronawirusów przedstawiono w tabeli 1 [4]. Zastosowanie jako antygenu wyłącznie podjednostki S1 białka S skutkuje wysoką specyficznością testu serologicznego.
| N | S | S1 | S2 | ||
| Beta-CoV | SARS-CoV | 90 | 77 | 66 | 90 |
| MERS-CoV | 49 | 33 | 24 | 43 | |
| HCoV-OC43 | 34 | 33 | 25 | 42 | |
| HCoV-HKU1 | 34 | 32 | 25 | 40 | |
| Alpha-CoV | HCoV-229E | 28 | 30 | 24 | 35 |
| HCoV-NL63 | 29 | 28 | 21 | 36 | |
Tab. 1. Porównanie podobieństwa sekwencji aminokwasowych (%) wybranych białek SARS-CoV-2 z analogicznymi regionami innych koronawirusów [4].
Co więcej, wykazano, że w przypadku zakażeń SARS-CoV-2 wniknięcie wirusa do komórki docelowej odbywa się poprzez domenę wiążącą receptor obecną na podjednostce S1 białka S, która łączy się z receptorem ACE2 (ang. angiotensin-converting enzyme 2) znajdującym się na komórkach nabłonka pęcherzyków płucnych [6]. Wydaje się więc, że przeciwciała skierowane przeciwko białku S mogą pełnić kluczową rolę w mechanizmach odporności przeciwko COVID-19 [7] [8]. Wykazano również ścisłą korelację pomiędzy testem EUROIMMUN Anty-SARS-CoV-2 ELISA opartym o wysokospecyficzną podjednostkę S1 białka S SARS-CoV-2 a testem neutralizacji PRNT (ang. plaque reduction neutralization test) [9] [4]. Niedawno przedstawiono wyniki badań naukowców z Uniwersytetu w Bonn, w których potwierdzono bardzo dobrą korelację testu EUROIMMUN z testem neutralizacji na poziomie 91% [10]. Test PRNT uważa się za „złoty standard” pomiaru skuteczności przeciwciał w neutralizowaniu wirusów chorobotwórczych [11].
Zapewnienie precyzyjnej detekcji przeciwciał w diagnostyce COVID-19 było głównym celem niemieckich ekspertów, którzy stworzyli zestaw testowy EUROIMMUN Anty-SARS-CoV-2 ELISA (IgA, IgG). Testy umożliwiają wysokospecyficzne, półilościowe oznaczenie przeciwciał przeciwko SARS-CoV-2. Jako antygenu użyto podjednostki S1 białka S nowego koronawirusa.
Nowość: test EUROIMMUN Anty-SARS-CoV-2-NCP ELISA
Nowością na rynku diagnostycznym są testy EUROIMMUN Anty-SARS-CoV-2-NCP ELISA (IgM, IgG) oparte o modyfikowane białko nukleokapsydu (ang. nucleocapsid protein, NCP), które jest unikalnym antygenem. W celu zapewnienia wysokiej specyficzności testów naukowcy z firmy EUROIMMUN usunęli fragmenty białka N, które mogą skutkować wysoką reaktywnością krzyżową przeciwciał przeciwko powszechnie występującym koronawirusom.
Piśmiennictwo
- World Health Organization, Laboratory testing for coronavirus disease (COVID-19) in suspected human cases: interim guidance, 19 March 2020, https://apps.who.int/iris/handle/10665/331501.
- Zhao J. i wsp., Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019, Clinical Infectious Diseases, 28 March 2020, https://doi.org/10.1093/cid/ciaa344.
- Lu R. i wsp., Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding, Lancet, 2020, 395 (10224): 565–574.
- Okba N.M.A. i wsp., Severe Acute Respiratory Syndrome Coronavirus 2 − Specific Antibody Responses in Coronavirus Disease 2019 Patients, Emerging Infectious Diseases, 2020, 26 (7), https://doi.org/10.3201/eid2607.200841.
- Kevin Ng. i wsp., Pre-existing and de novo humoral immunity to SARS-CoV-2 in humans, medRxiv (Preprint), 15 May 2020, https://doi.org/10.1101/2020.05.14.095414.
- Zhou G., Zhao Q., Perspectives on therapeutic neutralizing antibodies against the Novel Coronavirus SARS-CoV-2, International Journal of Biological Sciences, 2020, 16 (10): 1718–1723.
- Padoan A. i wsp., IgA-Ab response to spike glycoprotein of SARS-CoV-2 in patients with COVID-19: A longitudinal study, Clinica Chimica Acta, 2020, 507: 164–166, https://doi.org/10.1016/j.cca.2020.04.026.
- Yu S. i wsp., Retrospective Serological Investigation of Severe Acute Respiratory Syndrome Coronavirus Antibodies in Recruits from Mainland China, Clin Diagn Lab Immunol. 2005, 12 (4): 552–554, https://doi.org/10.7150/ijbs.45123.
- Amanat F. i wsp., A serological assay to detect SARS-CoV-2 seroconversion in humans, Nature Medicine, 2020, https://doi.org/10.1038/s41591-020-0913-5.
- Streeck H. i wsp., Infection fatality rate of SARS-CoV-2 infection in a German community with a super-spreading event, medRxiv (Preprint), 8 May 2020, https://doi.org/10.1101/2020.05.04.20090076.
- Thomas S.J. i wsp., Dengue plaque reduction neutralization test (PRNT) in primary and secondary dengue virus infections: How alterations in assay conditions impact performance, The American Journal of Tropical Medicine and Hygiene, 2009, 81 (5): 825–833, https://doi.org/10.4269/ajtmh.2009.08-0625.

Barbara Pawłowska
Zastępca Kierownika Działu Informacji Naukowej, Kierownik ds. Szkoleń On-line





Dodaj komentarz