Wybierz język:
Wywiad z Założycielem i Dyrektorem Generalnym EUROIMMUN AG – Profesorem Winfriedem Stöckerem.
Czy możesz nam opowiedzieć o historii odkryć w dziedzinie autoimmunologicznych chorób neurologicznych?
Wkrótce po wprowadzeniu testów immunofluorescencji pośredniej, u pacjentów cierpiących na różne choroby neurologiczne wykryto autoprzeciwciała reagujące z tkanką nerwową. Pierwsze odkrycia dotyczyły przeciwciał przeciw antygenom wewnątrzkomórkowym: jądrom neuronów (przeciwciała takie, jak anty-Hu i anty-Ri), a także cytoplazmie komórek Purkiniego (na przykład przeciwciała anty-Yo).
Autoprzeciwciała anty-Hu występują szczególnie w przypadku schorzeń neuronów czuciowych i zapalenia mózgu, zajmującego głównie pień mózgu, móżdżek i układ limbiczny. Często są związane z nowotworami: drobnokomórkowym nowotworem płuc (SCLC), nerwiakiem zarodkowym, nowotworem gruczołu krokowego. Przeciwciała te mogą wcześnie wskazywać na występowanie nowotworu.
Autoprzeciwciała przeciw onkoneuralnym białkom Ri, NOVA-1 i NOVA-2 wykryto w zespole opsokloniczno-mioklonicznym w związku z nowotworem, głównie nowotworem piersi, ale także z drobnokomórkowym nowotworem płuc. Przeciwciała anty-Ri mogą być pierwszą oznaką nowotworu.
Autoprzeciwciała anty-Yo wskazują na paranowotworowy (paraneoplastyczny) zespół móżdżkowy. Zazwyczaj są one również związane z konkretnymi nowotworami, najczęściej nowotworem jajnika, piersi i macicy, ale obserwowano je również przy nowotworze gruczołu krokowego czy gruczolakoraku przełyku. W wielu przypadkach zespół móżdżkowy jest diagnozowany przed nowotworem.
Do końca XX w. diagnostyka ograniczała się do opisanych autoprzeciwciał i kilku innych przeciwciał przeciwko antygenom wewnątrzkomórkowym, a reakcje z cytoplazmą zamrożonych skrawków tkanki nerwowej uznawano za „niespecyficzne”. Dziś wiadomo, że tak naprawdę są to reakcje przeciwciał z powierzchnią neuronów, szczególnie z neuroreceptorami. Przełomem było odkrycie przeciwciał przeciw akwaporynie 4 (antygenowi kanałów wodnych, 2004) i receptorowi kwasu glutaminowego typu NMDA (kwas N-metylo-D-asparaginowy, 2007), a także przeciw białkom związanym z kanałami potasowymi (LGI1 i CASPR2, 2010). Od tego czasu każdego roku odkrywamy wiele nowych autoprzeciwciał przeciw tkance nerwowej.
W diagnostyce laboratoryjnej badanie autoprzeciwciał przeciw akwaporynie 4 służy do potwierdzenia diagnozy neuromyelitis optica (NMO, zapalenie nerwów wzrokowych i rdzenia, zespół Devica). Objawy NMO to ostre zaburzenia widzenia, aż do przejściowej utraty widzenia w jednym lub obu oczach w ciągu kilku godzin do kilku dni, a także objawy paraplegii z częściowo zaostrzającymi się objawami.
Zapalenie mózgu z przeciwciałami przeciw receptorowi NMDA jest chorobą autoimmunologiczną, opisaną po raz pierwszy w 2007 r. W niektórych przypadkach wiąże się ono z potworniakiem jajników (rzadko jąder; tkanka nowotworowa zawiera między innymi struktury nerwowe). Pierwszymi objawami są często napady padaczkowe i zaburzenia świadomości oraz objawy podobne do katatonii. Charakterystyczna jest obecność autoprzeciwciał przeciw receptorowi NMDA w surowicy i płynie mózgowo-rdzeniowym.
Autoprzeciwciała przeciw LGI1 są w ≥90% przypadków związane ze specyficzną postacią autoimmunologicznego limbicznego zapalenia mózgu. Autoprzeciwciała przeciw CASPR2 występują przeważnie (w 53%) u pacjentów cierpiących na neuromiotonię lub zespół Morvana oraz na zapalenie mózgu. Należą one do grupy fakultatywnych przeciwciał w zespołach paraneoplastycznych: w 10–30% przypadków zespoły neurologiczne mają etiologię paranowotworową, co oznacza, że wykrycie przeciwciała może wskazywać na obecność nowotworu (grasiczak i inne).
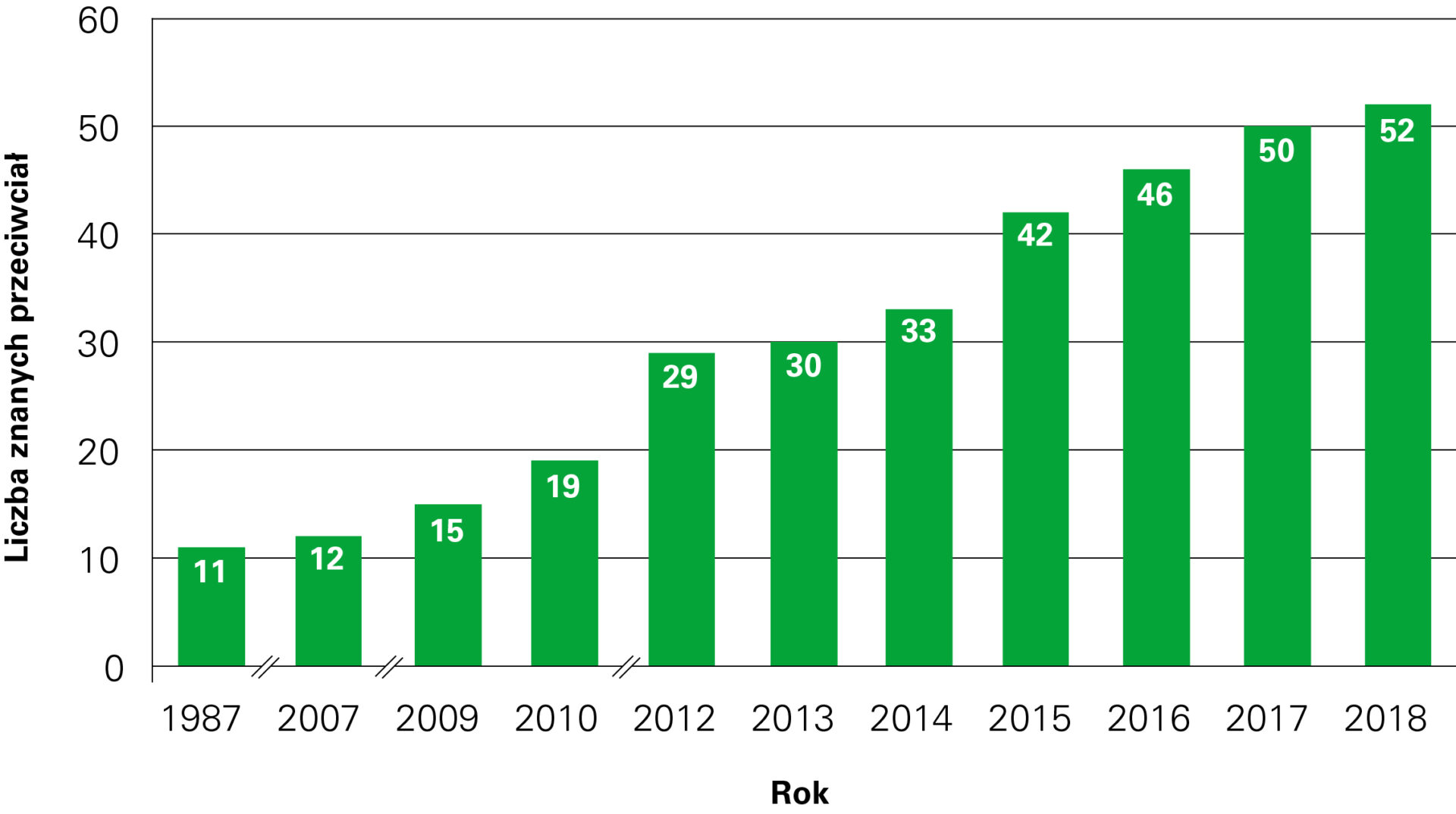
Wskazane jest wykonanie równoległych testów na obecność innych najważniejszych autoprzeciwciał przeciw antygenom onkoneuronalnym (ponad 50 autoprzeciwciał), co w wielu przypadkach daje szybką i pewną (czasami nieoczekiwaną) diagnozę, istotną dla przeżycia pacjenta.
Przeciwciała występujące u pacjentów z autoimmunologicznym zapaleniem mózgu:
| Rok | Przeciwciała przeciwko | Liczba znanych przeciwciał |
| 1987–2006 | Hu (ANNA-1), Yo (PCA-1), Ri (ANNA-2), ANNA-3, Ma (Ta), CV-2 (CRMP5), PCA-2, GAD65, GAD67, amfifizyna, mielina | 11 |
| 2007 | MAG | 12 |
| 2009 | Receptor glutaminianu (typ NMDA), receptor glutaminianu (typ AMPA), akwaporyna-4 (AQP4) | 15 |
| 2010 | LGI-1, CASPR2, receptor GABA-B, receptory glicyny | 19 |
| 2012 | mGluR1, mGluR5, MOG, DPPX, Tr (DNER), ZIC-4, SOX-1 (AGNA), ARHGAP26, tytyna, rekoweryna | 29 |
| 2013 | Receptor dopaminy | 30 |
| 2014 | Receptor GABA-A, IgLON-5, AGNA | 33 |
| 2015 | KCNA2, Homer-3, CARP VIII, ITPR1, GluRD2, CNTN2, flotylina, neurochondryna, neurofascyna | 42 |
| 2016 | AT1A3, ERC1, GFAP, neureksyna | 46 |
| 2017 | CNTN1/CASPR, KCNA1, GRID2, CDR3 | 50 |
| 2018 | AP3B2, Sez6I2 | 52 |
ANNA-1: anti-neuronal nuclear antibody 1; ANNA-2: anti-neuronal nuclear antibody 2; ANNA-3: anti-neuronal nuclear antibody 3; PCA-1: anti-Purkinje cell antibody 1; PCA-2: anti-Purkinje cell antibody 2; CRMP5: collapsing response-mediated protein 5; GAD: glutamic acid decarboxylase; NMDA: N-methyl-D-aspartate; AMPA: alfa-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid; GABA: gamma-aminobutyric acid; LGI1: leucine-rich, glioma inactivated 1; CASPR2: contactin associated protein 2; mGluR1: metabotropic glutamate receptor 1; mGluR5: metabotropic glutamate receptor 5; MOG: myelin-associated glikoprotein; DPPX: dipeptidyl aminopeptidase-like protein 6; DNER: delta/notch-like epidermal growth factor-related receptor; ZIC-4: zic family member 4; AGNA: anti-glial nuclear antibody; ARHGAP26: RhoGTPase activating protein 26; IgLON-5: IgLON Family Member 5; KCNA2: Potassium voltage-gated channel subfamily A member 2; CARP VIII: carbonic anhydrase related protein VIII; ITPR1: inositol 1,4,5-trisphosphate receptor type 1; GluRD2: glutamate receptor ionotropic, delta-2; CNTN1: contactin 1; CNTN2: contactin 2; ATP1A3: sodium/potassium-transporting ATPase subunit alpha-3; ERC1: ELKS/RAB6-Interacting/CAST Family Member 1; GFAP: glial fibrillary acidic protein; GRID2: glutamate ionotropic receptor delta type subunit 2; CDR3: complementarity determining region 3; AP3B2: AP-3 complex subunit beta-2; Sez6I2: anti-seizure-related 6 homolog like 2.
Dynamiczny rozwój neuroimmunologii w latach 1987–2018.
Jakie są główne kategorie przeciwciał antyneuronalnych?
Określenie „przeciwciała antyneuronalne” wyklucza na przykład przeciwciała przeciw akwaporynie 4, dlatego lepiej jest mówić o przeciwciałach antyneuralnych. Można je podzielić na dwie grupy: przeciwciała antyneuralne przeciw antygenom wewnątrzkomórkowym, takie jak anty-Hu, anty-Ri i anty-Yo, oraz przeciwciała antyneuralne przeciw antygenom zewnątrzkomórkowym, takim jak receptory synaptyczne, oraz innym antygenom powierzchniowym komórki (kanały wodne lub potasowe). Można również podzielić je ze względu na powiązanie z nowotworem: przeciwciała antyneuralne ze współistniejącym nowotworem (przeciwciała onkononeuronalne) lub bez obecności nowotworu.
Co wiemy na temat mechanizmu powstawania neurologicznych zespołów paranowotworowych?
Neurologiczne zespoły paranowotworowe (NZP) są powikłaniami chorób nowotworowych, nie są one jednak wywołane bezpośrednio przez nowotwór lub jego przerzuty. Antygeny onkoneuronalne występują w różnych typach nowotworów, a także w prawidłowych komórkach ośrodkowego układu nerwowego. Produkcja autoprzeciwciał jest prawdopodobnie indukowana przez obecność antygenów nowotworu, które są swobodnie dostępne dla układu immunologicznego, w przeciwieństwie do antygenów tkanki nerwowej, które są izolowane poprzez barierę krew–płyn mózgowo-rdzeniowy.
Które przeciwciała należy zbadać w przypadku podejrzenia neurologicznego zespołu paranowotworowego?
Wskazane jest badanie nie tylko parametrów wymaganych przez klinicystę, ale jednoczesne i równoległe badanie wszystkich obecnie znanych istotnych autoprzeciwciał przeciwko antygenom onkoneuronalnym i neuronalnym. Dzięki temu w wielu przypadkach (przy co trzeciej pozytywnej reakcji) uzyskuje się szybką diagnozę, która wcześniej mogła nie być brana pod uwagę, a jest istotna dla przeżycia pacjenta. W celu zbadania całego spektrum przeciwciał antyonkoneuronalnych przy użyciu metody immunofluorescencji pośredniej można skorzystać z mozaiki BIOCHIP-ów. Jest to zbiór ponad 20 substratów tkankowych i różnych komórek rekombinowanych, umieszczonych obok siebie na szkiełku reakcyjnym, co umożliwia ich jednoczesną inkubację z próbką pacjenta. Pozytywne wyniki bardzo łatwo jest zidentyfikować dzięki zastosowaniu mikroskopu fluorescencyjnego. Wyniki można potwierdzić i uzupełnić, korzystając z metody immunoblot. W tym celu można zastosować testy typu Western blot zawierające ekstrakty z móżdżku i hipokampu lub testy lineblot z antygenami rekombinowanymi. Testy Western blot zapewniają pełne spektrum antygenów, a lineblot jedynie wybrane antygeny rekombinowane, których odczyt jest jednak dużo mniej skomplikowany
Czym są testy komórkowe (cell-based assay, CBA) i dlaczego są one coraz częściej stosowane w tej dziedzinie?
W monospecyficznych testach na obecność wielu autoprzeciwciał antyneuralnych stosuje się transfekowane komórki HEK (human embryonic kidney cells), w których następuje osobna, monospecyficzna ekspresja różnych antygenów neuralnych.
Jakie testy zaleciłbyś jako test podstawowy, od którego powinno się zaczynać badania diagnostyczne pod kątem przeciwciał antyneuralnych?
Złotym standardem w badaniach autoprzeciwciał przeciwko antygenom onkoneuronalnym jest przeprowadzenie testu immunofluorescencji pośredniej przy użyciu zamrożonych fragmentów następujących tkanek naczelnych: hipokampu, mózgu, móżdżku, nerwów obwodowych, jelita płodu, trzustki, wątroby.
Jako przykład weźmy autoprzeciwciała przeciw akwaporynie 4. Ich oznaczenie jest możliwe za pomocą testu radioimmunoprecypitacji (RIPA), ale jego czułość wynosi zaledwie 56%. Alternatywnie można użyć testu immunoprecypitacji fluorescencyjnej (FIPA). Istnieje również test oparty na sortowaniu komórek (FACS), w którym jako docelowy antygen stosuje się komórki HEK-293 transfekowane akwaporyną 4 (AQP4). Ten test jest jednak zarezerwowany dla wyspecjalizowanych laboratoriów i nie jest wystarczająco dobrze wystandaryzowany.
Metodą z wyboru jest obecnie komórkowy test immunofluorescencji pośredniej z użyciem komórek HEK transfekowanych akwaporyną 4 jako substratem. Przeciwciała przeciwko AQP4 powodują powstanie w cytoplazmie łatwo rozpoznawalnej, gładkiej do drobnoziarnistej fluorescencji. Czułość konwencjonalnego testu IIFT (z substratami tkankowymi) wynosi 65%, a specyficzność 100%. Czułość można zwiększyć do ponad 85% przez dodanie etapu pośredniego: najpierw próbka, następnie surowica AB jako źródło dopełniacza, następnie znakowane FITC przeciwciało anty-C1q, anty-C3 lub anty-C4. W przypadkach z wynikiem pozytywnym prawie wszystkie obszary tkanki ośrodkowego układu nerwowego wykazują wyraźną fluorescencję w formie smug.
Przy użyciu mozaiki BIOCHIP-ów, zawierającej mrożone skrawki móżdżku, mózgu, hipokampu i nerwu wzrokowego oraz inne substraty, na przykład komórkowe z rekombinowanymi antygenami neuronalnymi, możliwe jest badanie wielu autoprzeciwciał w trakcie jednej inkubacji i jednocześnie zbadanie innych autoprzeciwciał istotnych dla diagnostyki różnicowej. W wielu przypadkach pozwala to na szybkie postawienie pewnej (czasami nieoczekiwanej) diagnozy, istotnej dla przeżycia pacjenta. Do inkubacji używa się równolegle dwóch wyjściowych rozcieńczeń – 1:10 i 1:100. Bada się immunoglobuliny klasy IgA, IgG i IgM – dla większej pewności, prowadząc osobne inkubacje.
Jakiego rodzaju próbki powinny być użyte do analizy: sama surowica czy surowica i płyn mózgowo-rdzeniowy (PMR)?
W większości przypadków testów z użyciem surowicy wyniki uzyskujemy szybciej, a miana przeciwciał są zwykle wyższe niż w płynie mózgowo-rdzeniowym. Jeśli w surowicy nic nie znajdziemy, w indywidualnych przypadkach można wykryć przeciwciała w PMR. Jeśli jednak istnieje podejrzenie choroby o dłuższym przebiegu, bada się poziom przeciwciał w obu płynach, aby poznać ich wartości początkowe.
W neurologii autoimmunizacja nie jest jedynym przedmiotem zainteresowania EUROIMMUN. Drugi to choroby neurodegeneracyjne. Czy możesz nam opowiedzieć o biomarkerach, które analizuje się w przypadku tej grupy schorzeń? Czy u pacjentów cierpiących na chorobę Alzheimera zaobserwowano ostatnio jakieś nowe biomarkery/przeciwciała?
Jeśli chodzi o chorobę Alzheimera, rutynowo badane są następujące parametry: patologiczny poziom amyloidów można ocenić, mierząc beta-amyloidy (1–40) i (1–42), natomiast w przypadku patologii białka tau bada się poziom całkowitego białka tau oraz fosforylowanego białka tau w próbkach płynu mózgowo-rdzeniowego. Jednoczesne badanie opisanych parametrów może dać jasny obraz tego, czy u pacjenta rzeczywiście występuje choroba Alzheimera lub inny rodzaj demencji.
W kontekście choroby Alzheimera badane są również inne markery integralności neuronalnej i markery synaptyczne, takie jak BACE-1 (beta-secretase 1) lub neurogranina, w celu lepszego zrozumienia ogólnego mechanizmu występowania i rozwoju choroby.
W innych chorobach neurodegeneracyjnych przydatny może być pomiar innych markerów, na przykład alfa-synukleiny w chorobie Parkinsona czy neurofilamentów w diagnostyce stwardnienia zanikowego bocznego lub w monitorowaniu leczenia stwardnienia rozsianego.
Pomiary poziomu białka tau i neurofilamentów odgrywają ważną rolę również w przypadku urazowego uszkodzenia mózgu.
Czy u pacjentów niemieckich z łagodnymi objawami rutynowo przeprowadza się badania diagnostyczne w kierunku choroby Alzheimera?
Aby wesprzeć diagnozę choroby Alzheimera, pomiar białek amyloidowych i białka tau został już uwzględniony w rekomendacjach diagnostycznych. Naszymi głównymi klientami w Niemczech są obecnie laboratoria diagnostyki ogólnej.
Lekarze i pacjenci zyskują coraz większą świadomość w zakresie chorób demencyjnych, a także możliwość wczesnego wykrycia ryzyka rozwoju takiej choroby.
Dlatego coraz więcej pacjentów we wczesnych stadiach łagodnych zaburzeń poznawczych wymaga takiego badania.
A leczenie choroby Alzheimera? Czy masz jakieś wieści z branży farmaceutycznej?
Kilka leków przeciwamyloidowych znajduje się w III fazie badań. Potencjalnymi lekami są również te przeciw białku tau oraz inhibitory BACE-1.
Wszystkie główne firmy farmaceutyczne skupiają się na opracowaniu nowych leków, ale obecnie właściwie żadne nie są jeszcze dostępne. Wydaje się jednak, że nadejście przełomu to tylko kwestia czasu. Do tej pory pacjentom pozostaje ćwiczyć pamięć poprzez uczenie się nowych języków lub wierszy.
Dziękuję za rozmowę.
Rozmawiała: Małgorzata Klimczak-Filippowicz
Neuroimmunologie – neue Forschungsmöglichkeiten griffbereit
Interview mit Prof. Dr. med. Winfried Stöcker, Gründer und Geschäftsführer der EUROIMMUN AG.
Können Sie uns etwas über die Geschichte der Entdeckungen im Bereich von Autoimmunität in neurologischen Erkrankungen erzählen?
Bei Patienten mit verschiedenen neurologischen Erkrankungen sind schon kurz nach der Einführung der indirekten Immunfluoreszenz Autoantikörper aufgefallen, die mit neurologischem Gewebe reagieren. Die ersten Entdeckungen betrafen Antikörper gegen intrazelluläre Antigene: Gegen die Zellkerne der Neuronen, unter ihnen Anti-Hu und Anti-Ri, sowie Antikörper gegen das Cytoplasma der Purkinjezellen: Anti-Yo.
Autoantikörper gegen Hu kommen vor insbesondere bei sensibler Neuronopathie und bei Enzephalitis mit Schwerpunkt in Hirnstamm, Kleinhirn und limbischem System. Häufig sind mit Anti-Hu-Antikörpern Tumore assoziiert: Kleinzelliges Lungenkarzinom (SCLC), Neuroblastom, Prostatakarzinom. Die Antikörper können den ersten Hinweis auf einen zugrundeliegenden Tumor geben.
Autoantikörper gegen die onkoneuronalen Ri-Proteine NOVA-1 und NOVA-2 wurden bei Opsoklonus-Myoklonus-Syndrom in Zusammenhang mit einem Tumor beschrieben, vorwiegend mit Mamma-Karzinom, aber auch mit einem kleinzelliges Lungenkarzinom. Anti-Ri-Antikörper können den ersten Hinweis auf einen zugrundeliegenden Tumor geben.
Autoantikörper gegen Yo weisen auf ein symptomatisches (paraneoplastisches) Kleinhirnsyndrom hin. In der Regel sind auch sie mit bestimmten Tumoren assoziiert, am häufigsten mit Ovar-, Mamma- und Uteruskarzinom, sie wurden aber auch bei Prostatakarzinom oder Adenokarzinom des Ösophagus beobachtet. Auch hier wird in vielen Fällen das Kleinhirnsyndrom klinisch vor dem Tumor diagnostiziert.
Bis zum Ende des 20. Jahrhunderts hat man sich in der Diagnostik auf diese beschriebenen Antikörper und gegen wenige andere intrazelluläre Antigene beschränkt und die Reaktionen mit dem Cytoplasma der Gefrierschnitte des neurologischen Gewebes als „unspezifisch“ angesehen, die vorwiegend durch Reaktionen die Oberfläche der Neuronen bedingt waren – vor allem gegen die unterschiedlichsten Rezeptoren der Synapsen. Die Entdeckung der Antikörper gegen Aquaporin 4 (Antigene der Wasserkanäle, 2004) und gegen Glutamatrezeptoren, Typ NMDA (N-Methyl-D-Aspartat, 2007), sowie gegen Kaliumkanal-assoziierte Proteine (LGi1 und CASPR2, 2010) führte zu einem Dammbruch, und seither wurden jedes Jahr viele neue antineurale Autoantikörper entdeckt.
Labordiagnostisch sichert die Untersuchung der Autoantikörper gegen Aquaporin-4 die Diagnose Neuromyelitis optica (NMO, besser: Optikospinale Enzephalomyelitis, Devic-Syndrom). Die Krankheitszeichen der NMO sind zum einen akute Sehstörungen bis hin zur Erblindung (Amaurosis) eines oder beider Augen innerhalb von Stunden bis Tagen, zum anderen Symptome eines Querschnittsyndroms mit teilweise aufsteigender Symptomatik.
Die Anti-NMDA-Rezeptor-Enzephalitis ist eine erstmals 2007 beschriebene Autoimmunerkrankung. Sie ist in einigen Fällen mit einem Teratom der Ovarien assoziiert (selten: der Testes; die Tumoren enthalten unter anderem neuronale Strukturen). Erste Anzeichen sind oft epileptische Anfälle und Katatonie-ähnliche Bewusstseinsstörungen. Charakteristisch sind Autoantikörper gegen NMDA-Rezeptoren in Serum und Liquor.
Autoantikörper gegen LGI1 sind zu ≥90% mit einer speziellen Form autoimmuner limbischer Enzephalitis assoziiert. Anti-CASPR2-Autoantikörper finden sich überwiegend (53%) bei Patienten mit Neuromyotonie oder Morvan-Syndrom und bei Enzephalitis. Sie gehören zur Gruppe der fakultativ paraneoplastischen Antikörper: In 10–30% der Fälle liegt den neurologischen Syndromen eine paraneoplastische Ätiologie zu Grunde, d. h. ein positiver Antikörperbefund kann ein Hinweis für das Vorliegen eines Tumors (Thymom u. a.) sein.
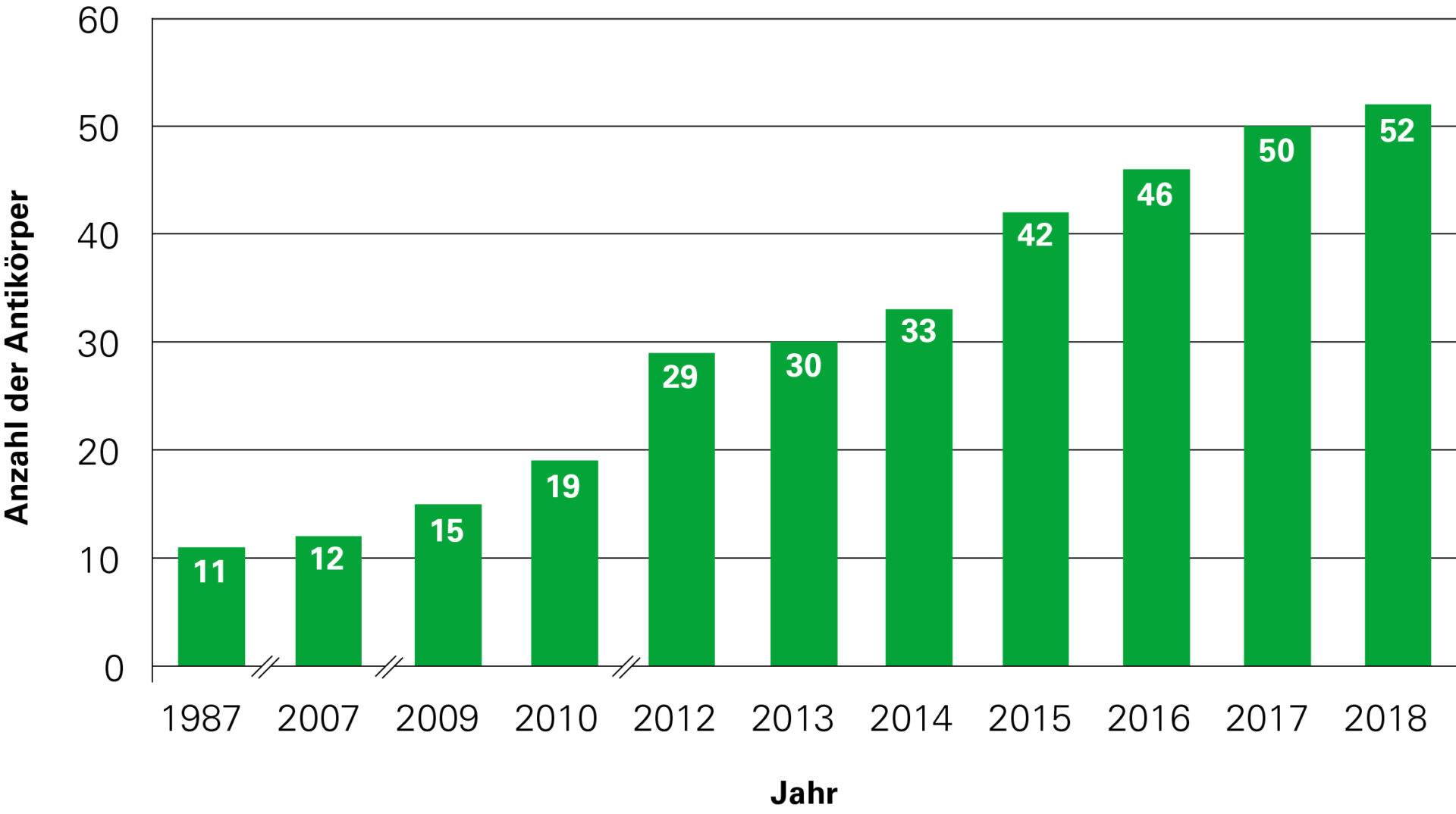
Es empfiehlt sich, zusätzlich die wichtigsten anderen Autoantikörper gegen onkoneuronale Antigene parallel zu untersuchen, was in vielen Fällen eine schnelle und sichere (ggf. unvermutete) lebenswichtige Diagnose zur Folge hat.
Autoantikörper bei autoimmuner Enzephalitis:
| Jahr | Antikörper gegen | Anzahl |
| 1987–2006 | Hu, Yo, Ri, ANNA-3, Amphiphysin, Ma, CV-2, Myelin, PCA-2, GAD65, GAD67 | 11 |
| 2007 | MAG | 12 |
| 2009 | Glutamatrezeptoren (Typ NMDA), Glutamatrezeptoren (Typ AMPA), Aquaporin-4 | 15 |
| 2010 | 2010 Glycin-Rezeptoren, GABA-b-Rezeptoren, LGI-1, CASPR2 19 | 19 |
| 2012 | Titin, Recoverin, mGluR1, mGluR5, ARHGAP26, MOG, DPPX, Tr/DNER, ZIC-4, SOX-1 | 29 |
| 2013 | Dopaminrezeptoren | 30 |
| 2014 | GABA-a-Rezeptoren, IgLON-5, AGNA | 33 |
| 2015 | Flotillin, Neurochondrin, Neurofascin, KCNA2, Homer-3, CARP VIII, ITPR1, GluRD2, CNTN2 | 42 |
| 2016 | AT1A3, Neurexin, ERC1, GFAP | 46 |
| 2017 | CNTN1/CASPR, KCNA1, GRID2, CDR3 | 50 |
| 2018 | AP3B2, Sez6I2 | 52 |
ANNA-1: anti-neuronal nuclear antibody 1; ANNA-2: anti-neuronal nuclear antibody 2; ANNA-3: anti-neuronal nuclear antibody 3; PCA-1: anti-Purkinje cell antibody 1; PCA-2: anti-Purkinje cell antibody 2; CRMP5: collapsing response-mediated protein 5; GAD: glutamic acid decarboxylase; NMDA: N-methyl-D-aspartate; AMPA: alfa-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid; GABA: gamma-aminobutyric acid; LGI1: leucine-rich, glioma inactivated 1; CASPR2: contactin associated protein 2; mGluR1: metabotropic glutamate receptor 1; mGluR5: metabotropic glutamate receptor 5; MOG: myelin-associated glikoprotein; DPPX: dipeptidyl aminopeptidase-like protein 6; DNER: delta/notch-like epidermal growth factor-related receptor; ZIC-4: zic family member 4; AGNA: anti-glial nuclear antibody; ARHGAP26: RhoGTPase activating protein 26; IgLON-5: IgLON Family Member 5; KCNA2: Potassium voltage-gated channel subfamily A member 2; CARP VIII: carbonic anhydrase related protein VIII; ITPR1: inositol 1,4,5-trisphosphate receptor type 1; GluRD2: glutamate receptor ionotropic, delta-2; CNTN1: contactin 1; CNTN2: contactin 2; ATP1A3: sodium/potassium-transporting ATPase subunit alpha-3; ERC1: ELKS/RAB6-Interacting/CAST Family Member 1; GFAP: glial fibrillary acidic protein; GRID2: glutamate ionotropic receptor delta type subunit 2; CDR3: complementarity determining region 3; AP3B2: AP-3 complex subunit beta-2; Sez6I2: anti-seizure-related 6 homolog like 2.
Dynamische Entwicklung der Neuroimmunologie in den Jahren 1987–2018
Was sind die Hauptkategorien von anti-neuronalen Antikörpern?
Wenn man von Anti-neuronalen Antikörpern spricht, schließt man zum Beispiel die Anti-Aquaporin-4-Antikörper aus, wir sprechen daher lieber von Anti-neuralen Antiköpern. Und diese kann man in zwei Gruppen unterteilen: Anti-neurale Autoantikörper gegen intrazelluläre Antigene, wie Anti- Hu, Ri, Yo, oder gegen extrazelluläre Antigene, etwa die Rezeptoren der Synapsen und andere Bestandteile der Zelloberfläche, wie Wasser- oder Kaliumkanäle. Zweitens kann man auch gruppieren nach der Tumor-Assoziation: Anti-neurale Antikörper mit (onkoneuronale Antikörper) oder ohne begleitenden Tumor.
Was wissen wir über den Mechanismus von paraneoplastischen neurologischen Syndromen?
Paraneoplastische neurologischen Syndrome sind Komplikationen von Tumorerkrankungen, die nicht unmittelbar durch den Tumor oder seine Metastasen ausgelöst werden. Onkoneuronale Antigene sind sowohl in verschiedenen Tumoren, als auch in normalen Zellen des Zentralen Nervensystems zu finden. Die entsprechenden Autoantikörper werden wahrscheinlich durch diese Antigene des Tumors induziert, die dem Immunsystem frei zugänglich sind, im Gegensatz zu den durch die Blut-Liquor-Schranke abgeschotteten Antigenen des neurologischen Gewebes.
Welche Antikörper sollten bei Verdacht auf PNS untersucht werden?
Es empfiehlt sich, nicht nur die von den Klinikern angeforderten Parameter zu untersuchen, sondern primär alle wichtigen heute bekannten Autoantikörper gegen onkoneuronale und neurale Antigene, gleichzeitig, parallel. Dafür wird man in vielen Fällen durch eine schnelle und unvermutete lebenswichtige Diagnose entschädigt (bei jeder dritten positiven Reaktion). Zur Erfassung des gesamten Spektrums anti-onkoneuronaler Antikörper durch Immunfluoreszenz eignen sich Biochip-Mosaiken: 20 oder mehr Substrate aus Gewebeschnitten und unterschiedlichen rekombinanten Zellen werden auf einem Reaktionsfeld nebeneinander angeordnet und mit der Probe inkubiert. Positive Ergebnisse sind sehr leicht im Fluoreszenzmikroskop zu identifizieren. Sie können mit Hilfe von Immunblots bestätigt und ergänzt werden: Dazu verwendet man Western blots auf der Basis von Kleinhirn- und Hippocampus-Extrakten oder Linienblots mit rekombinanten Antigenen. Western blots bieten das komplette Antigenspektrum, Linienblots nur eine Auswahl rekombinanter Antigene. Linienblots sind jedoch leichter abzulesen.
Was sind zellbasierte Assays und warum werden sie auf diesem Gebiet immer öfter angewendet?
Zum monospezifischen Nachweis vieler anti-neuraler Autoantikörper werden transfizierte HEK-Zellen (Human Embryonic Kidney Cells) eingesetzt, die die unterschiedlichen neuralen Antigene separat monospezifisch exprimieren.
Was empfehlen Sie als Basistest, mit dem man diagnostische Untersuchungen von anti-neuralen Antikörpern beginnen sollte?
Goldstandard für die Untersuchung der Autoantikörper gegen onkoneuronale Antigene ist der indirekte Immunfluoreszenztest mit Gefrierschnitten folgender Primatengewebe: Hippocampus, Großhirn, Kleinhirn, peripherer Nerv, fetaler Darm, Pankreas, Leber.
Nehmen wir das Beispiel der Aquaporin-4-Autoantikörper: Ihre Bestimmung ist mittels Radioimmunopräzipitationsassay (RIPA) möglich, die Sensitivität beträgt aber nur 56%. Alternativ wurde ein Fluoreszenz-Immunpräzipitationstest (FIPA) beschrieben, und es gibt auch einen auf Zellsortierung (FACS) basierenden Test, bei dem transient mit Aquaporin transfizierte HEK-293-Zellen als Antigen-Target eingesetzt werden. Dieser Test ist spezialisierten Laboratorien vorbehalten und ist im allgemeinen schlecht standardisiert.
Methode der Wahl ist heute der zellbasierte indirekte Immunfluoreszenztest mit Aquaporin-4-transfizierten HEK-Zellen als Substrat (Human Embryonic Kidney Cells). Sie erzeugen im Cytoplasma eine leicht identifizierbare flächige, glatte bis feingranuläre Fluoreszenz. Die Sensitivität des konventionellen IIFT beträgt 65%, bei einer Spezifität von 100%. Die Sensitivität kann weiter auf über 85% gesteigert werden, wenn ein Komplementschritt dazwischengeschaltet wird: Erst die Probe, dann AB-Serum als Komplementquelle, dann FITC-markiertes Anti- C1q oder –C3 oder –C4. Dann zeigen die Gewebeschnitte nahezu aller Bereiche des ZNS im positiven Falle eine ausgeprägte streifige Fluoreszenz.
Mit einem Biochip-Mosaik, das Gefrierschnitte von Kleinhirn, Großhirn, Hippocampus und Sehnerv sowie weitere Zellsubstrate mit rekombinant exprimierten neuronalen Antigenen enthält, lassen sich die Reaktionen im selben Ansatz überprüfen, und gleichzeitig werden weitere differentialdiagnostisch relevante Autoantikörper erfasst, was in vielen Fällen eine schnelle und sichere (ggf. unvermutete) lebenswichtige Diagnose zur Folge hat. Es werden zwei Ausgangsverdünnungen parallel inkubiert, 1:10 und 1:100, untersucht werden die Immunglobulinklassen IgA, IgG und IgM, am sichersten in separaten Ansätzen.
Welche Art von Proben sollte zur Beurteilung benutzt werden: Serum allein oder Serum und CSF?
In den meisten Fällen kommt man mit Serum sehr schnell zum Ziel, und die Titer der Antikörper sind meistens höher als im Liquor. Findet man im Serum nichts, wird man in Einzelfällen im CSF fündig. Ist mit einem längeren Krankheitsverlauf zu rechnen, bestimmt man aber die Antikörper in beiden Flüssigkeiten, um über die Ausgangswerte bescheid zu wissen.
In der Neurologie ist Autoimmunität nicht der einzige Schwerpunkt von EUROIMMUN – der andere sind neurodegenerative Erkrankungen. Erzählen Sie uns bitte von Biomarkern, die bei diesen Krankheiten bewertet werden können? Gibt es neue Biomarker/ Antikörper, die in der letzten Zeit bei Patienten mit AE beobachtet wurden?
In Bezug auf die Alzheimer-Krankheit, werden die folgenden Parameter routinemäßig untersucht: Amyloidose kann durch die Messung von Beta-Amyloiden (1–40) und (1–42) bewertet werden, während in dem Fall von Tau-Pathologie Total-Tau-Proteine und phosphorylierte Tau-Proteine in CSF-Proben analysiert werden.
Zusammen können sie ein klares Bild liefern, ob tatsächlich die Alzheimer-Krankheit oder eine Demenz vom anderen Typ bei dem Patienten vorliegt.
Andere Marker der neuronalen Integrität und synaptische Marker, wie BACE-1 oder Neurogranin, im Kontext der Alzheimer-Krankheit werden noch untersucht, um ein besseres Verständnis der gesamten Pathologie und des Fortschritts der Krankheit zu gewinnen.
Bei anderen neurodegenerativen Erkrankungen kann die Messung von verschiedenen Marker hilfreich sein, zum Beispiel, Alpha-Synuclein bei der Parkinson-Krankheit oder Neurofilamente bei der Diagnose der amyotrophen Lateralsklerose oder bei der Behandlung der Multiple Sklerose.
Nach einer traumatischen Hirnverletzung spielen auch Tau-Proteine und Neurofilamente eine wichtige Rolle und weisen darauf hin, wie schwer ein möglicher Hirnschaden sein kann.
Werden diagnostische Tests für die Alzheimer-Krankheit routinemäßig bei deutschen Patienten mit milden Symptomen durchgeführt?
Um die Diagnose der Alzheimer-Krankheit zu unterstützen, umfassen die diagnostischen Richtlinien bereits die Messung von Amyloiden und Tau-Proteinen. Unsere Hauptkunden in Deutschland sind bereits allgemeine Labors.
Ärzte und Patienten gewinnen immer mehr Bewusstsein über die „Dementia“- Erkrankung, sowie die Möglichkeit, das Risiko der Entwicklung einer solchen Erkrankung früh zu erkennen.
Daher fordern immer mehr Patienten in einer frühen Phase von leichten kognitiven Problemen eine solche Untersuchung.
Und die Behandlung bei der Alzheimer-Krankheit? Haben Sie Neuigkeiten aus der Pharmaindustrie?
Es gibt mehrere Anti-Amyloid-Medikamente in Phase-III-Studien. Auch Anti-Tau-Medikamente und BACE-Inhibitoren sind neue Angriffspunkte für mögliche Medikamente.
Alle großen Pharmaunternehmen arbeiten hart an möglichen Medikamenten, aber im Moment gibt es eigentlich keine Behandlung. Aber es sollte nur eine Frage der Zeit sein, bis es zum Durchbruch kommt. Die Patienten sollten ihr Gehirn trainieren und Sprachen oder Gedichte lernen.
Herr Prof. Stöcker, vielen Dank für das Interview.
Interviewerin: Małgorzata Klimczak-Filippowicz
Neuroimmunology – new research capabilities
Interview with founder and CEO of EUROIMMUN AG – Professor Winfried Stöcker.
Could you tell us something about the history of discoveries on autoimmunity in neurological disorders?
Shortly after the introduction of indirect immunofluorescence, autoantibodies that react with neurological tissue were noticed in patients with various neurological diseases. Among the first discoveries were antibodies against intracellular antigens: against the cell nuclei of neurons, e.g. anti-Hu and anti-Ri, and against the cytoplasm of Purkinje cells, e.g. anti-Yo.
Autoantibodies against Hu occur particularly in sensory neuronopathies and in encephalitis affecting predominantly brainstem, cerebellum and limbic system. Anti-Hu antibodies are frequently associated with tumours: small-cell lung carcinoma (SCLC), neuroblastoma, prostate carcinoma. The antibodies may provide the first indication of an underlying tumour.
Autoantibodies against the onconeuronal Ri proteins NOVA-1 and NOVA-2 were described in opsoclonus-myoclonus syndrome in connection with tumours, especially breast carcinoma, but also SCLC. Anti-Ri antibodies may be the first indicator of an underlying tumour.
Autoantibodies against Yo indicate a symptomatic (paraneoplastic) cerebellar syndrome. Generally, they are also associated with particular tumours, most frequently with ovarian, breast and uterine carcinoma, but also with prostate carcinoma or adenocarcinoma of the oesophagus. Also here, in many cases the cerebellar syndrome is diagnosed before the tumour.
Up until the end of the 20th century, diagnostics were limited to the antibodies described above and antibodies against a few other intracellular antigens. Reactions with the cytoplasm of frozen sections of neurological tissue were considered “unspecific”. These were caused predominantly by reactions against antigens of the surface of neurons – especially against the many different synaptic receptors. The discovery of antibodies against aquaporin-4 (water channel antigen, 2004), glutamate receptors of type NMDA (N-methyl-D-aspartate, 2007) and potassium channel-associated proteins (LGI1 and CASPR2, 2010) led to an avalanche, and since then many new anti-neural autoantibodies have been discovered every year.
In laboratory diagnostics the investigation of autoantibodies against aquaporin-4 secures a diagnosis of neuromyelitis optica (NMO, better: opticospinal encephalomyelitis, Devic’s syndrome). The disease signs of NMO are, on the one hand, acute visual disorders up to blindness (amaurosis) in one or both eyes developing within hours or a few days, and on the other hand, symptoms of paraplegic syndrome, in part with advancing severity.
Anti-NMDA receptor encephalitis is an autoimmune disease which was first described in 2007. In some cases it is associated with ovarian teratoma (rarely: testicular teratoma; the tumours contain among other things neuronal structures). The first signs are often epileptic seizures and catatonia-like consciousness impairment. The disease is characterised by autoantibodies against NMDA receptors in serum and cerebrospinal fluid.
Autoantibodies against LGI1 have a ≥90% association with a special form of autoimmune limbic encephalitis. Anti-CASPR2 autoantibodies are found predominantly (53%) in patients with neuromyotonia or Morvan’s syndrome and in encephalitis. They belong to the group of facultative paraneoplastic antibodies. In 10–30% of cases the neurological syndromes have a paraneoplastic etiology. Thus, a positive antibody finding can indicate the presence of a tumour (e.g. thymoma).
It is advisable to additionally investigate the most important further autoantibodies against onconeuronal antigens in parallel, more than 50 parameters! In many cases this enables a rapid and secure (and sometimes unexpected) life-saving diagnosis.
Autoantibodies in autoimmune encephalitis:
| Year | Autoantibodies against | Number of known autoantibodies |
| 1987–2006 | Hu (ANNA-1), Yo (PCA-1), Ri (ANNA-2), ANNA-3, Ma (Ta), CV-2 (CRMP5), PCA-2, GAD65, GAD67, amphiphysin, myelin | 11 |
| 2007 | MAG | 12 |
| 2009 | Glutamate receptor (typ NMDA), glutamate receptor (typ AMPA), aquaporin-4 (AQP4) | 15 |
| 2010 | LGI-1, CASPR2, GABA-B receptor, glicine receptor | 19 |
| 2012 | mGluR1, mGluR5, MOG, DPPX, Tr (DNER), ZIC-4, SOX-1 (AGNA), ARHGAP26, titin, recoverin | 29 |
| 2013 | Dopamine receptor | 30 |
| 2014 | GABA-A receptor, IgLON-5, AGNA | 33 |
| 2015 | KCNA2, Homer-3, CARP VIII, ITPR1, GluRD2, CNTN2, flotilin, neurochondrin, neurofascin | 42 |
| 2016 | AT1A3, ERC1, GFAP, neurexin | 46 |
| 2017 | CNTN1/CASPR, KCNA1, GRID2, CDR3 | 50 |
| 2018 | AP3B2, Sez6I2 | 52 |
ANNA-1: anti-neuronal nuclear antibody 1; ANNA-2: anti-neuronal nuclear antibody 2; ANNA-3: anti-neuronal nuclear antibody 3; PCA-1: anti-Purkinje cell antibody 1; PCA-2: anti-Purkinje cell antibody 2; CRMP5: collapsing response-mediated protein 5; GAD: glutamic acid decarboxylase; NMDA: N-methyl-D-aspartate; AMPA: alfa-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid; GABA: gamma-aminobutyric acid; LGI1: leucine-rich, glioma inactivated 1; CASPR2: contactin associated protein 2; mGluR1: metabotropic glutamate receptor 1; mGluR5: metabotropic glutamate receptor 5; MOG: myelin-associated glikoprotein; DPPX: dipeptidyl aminopeptidase-like protein 6; DNER: delta/notch-like epidermal growth factor-related receptor; ZIC-4: zic family member 4; AGNA: anti-glial nuclear antibody; ARHGAP26: RhoGTPase activating protein 26; IgLON-5: IgLON Family Member 5; KCNA2: Potassium voltage-gated channel subfamily A member 2; CARP VIII: carbonic anhydrase related protein VIII; ITPR1: inositol 1,4,5-trisphosphate receptor type 1; GluRD2: glutamate receptor ionotropic, delta-2; CNTN1: contactin 1; CNTN2: contactin 2; ATP1A3: sodium/potassium-transporting ATPase subunit alpha-3; ERC1: ELKS/RAB6-Interacting/CAST Family Member 1; GFAP: glial fibrillary acidic protein; GRID2: glutamate ionotropic receptor delta type subunit 2; CDR3: complementarity determining region 3; AP3B2: AP-3 complex subunit beta-2; Sez6I2: anti-seizure-related 6 homolog like 2.
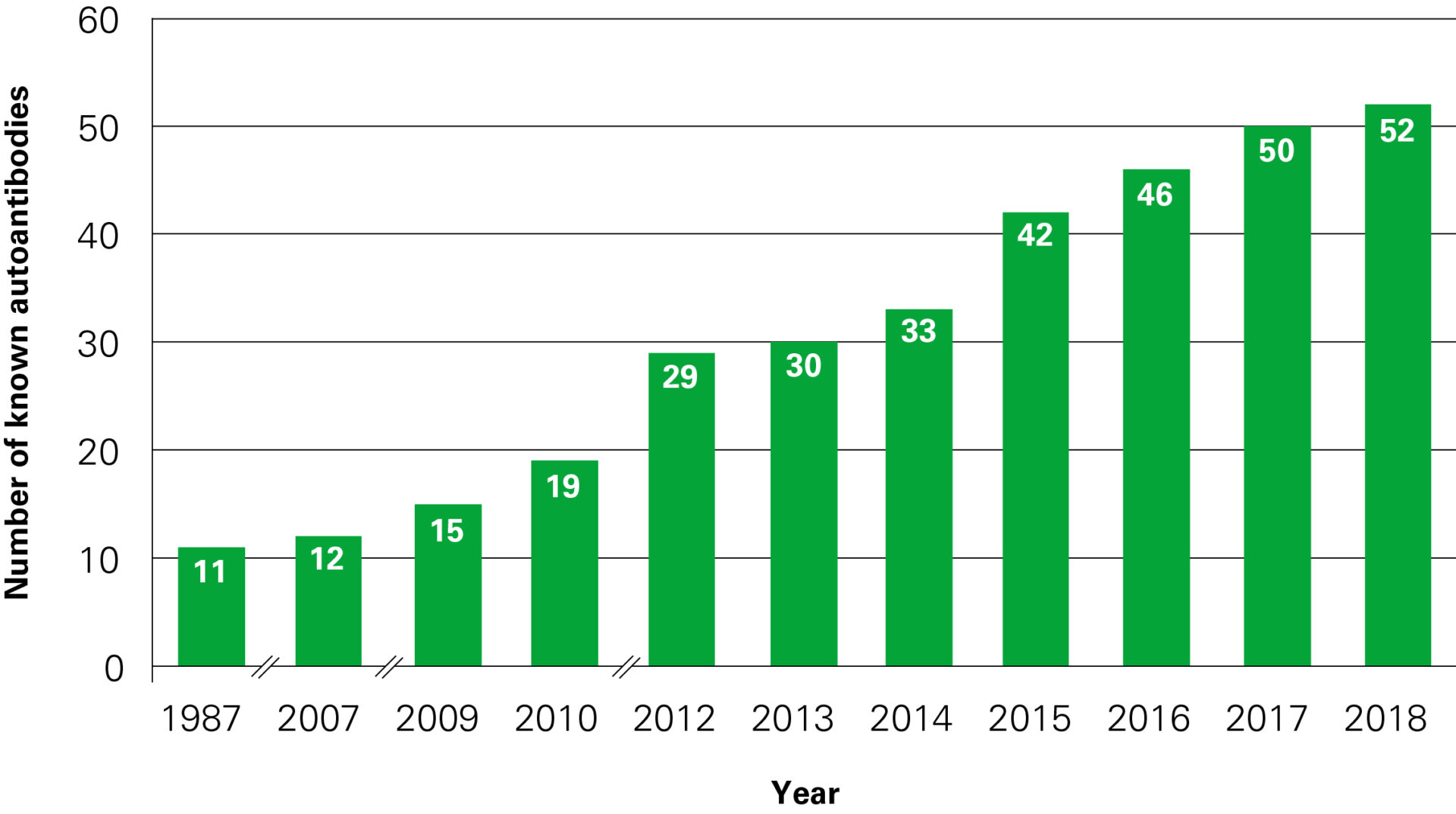
Dynamic development of neuroimmunology in the years 1987–2018
What are the main categories of anti-neuronal antibodies?
The term anti-neuronal antibodies excludes, for example, anti-aquaporin-4 antibodies. Therefore, we prefer to use the term anti-neural antibodies. These can be divided into two groups: anti-neural autoantibodies against intracellular antigens, for example anti-Hu, -Ri, -Yo, or against extracellular antigens, for example synaptic receptors and other cell-surface components such as water or potassium channels. The antibodies can also be grouped according to tumour association: anti-neural antibodies without or with accompanying tumour (onconeuronal antibodies).
What do we know about the pathomechanism of paraneoplastic neurological disorders?
Paraneoplastic neurological syndromes (PNS) are complications of tumour diseases that are not necessarily caused by the tumour or its metastases. Onconeuronal antigens are found both in various tumours and in normal cells of the central nervous system. The corresponding autoantibodies are probably induced by the tumour antigens, which are freely accessible for the immune system. In contrast, the antigens of the neurological tissue are insulated by the blood-CSF barrier.
Which antibodies should be evaluated in case of suspected PNS?
We recommend investigating not just the parameters requested by the clinician, but all currently known relevant autoantibodies against onconeuronal and neural antigens, simultaneously and in parallel. In many cases the effort is compensated by a rapid and unexpected life-saving diagnosis (every third positive reaction). The complete spectrum of anti-onconeuronal antibodies can be detected by immunofluorescence using BIOCHIP Mosaics: 20 or more substrates of tissue sections and different recombinant cells are arranged next to each other in a reaction field and incubated simultaneously with the sample. Positive results can be easily identified by fluorescence microscopy. They can be confirmed and supplemented using immunoblots: Western blots based on cerebellar and hippocampus extract or line blots with recombinant antigens. Western blots offer the complete antigen spectrum, line blots only a selection of recombinant antigens. Line blots are, however, easier to evaluate.
What are cell-based assays and why they are getting more and more popular in this field?
Transfected HEK (human embryonic kidney) cells are used for monospecific detection of many anti-neural autoantibodies. The cells express the different neural antigens separately and monospecifically.
What do you recommend implementing as a basic diagnostic to begin anti-neural antibody diagnostics?
The gold standard for the investigation of autoantibodies against onconeuronal antigens is the indirect immunofluorescence test (IIFT). If we take aquaporin-4 autoantibodies as an example: Their determination is possible using radioimmunoprecipitation assay (RIPA), but the sensitivity is only 56%. Alternatively, a fluorescence immunoprecipitation assay (FIPA) has been described and there is also a test based on cell sorting (FACS), in which HEK-293 cells transfected transiently with aquaporin are used as the antigenic target. This test is, however, restricted to specialised laboratories and is generally not well standardised, and the specificity insufficient.
The method of choice nowadays is the cell-based indirect immunofluorescence test with aquaporin-4-transfected HEK cells as substrate. The corresponding antibodies produce an easily identifiable widespread smooth to fine-granular fluorescence in the cytoplasm. The sensitivity of the conventional IIFT (with tissue substrate) is 65%, at a specificity of 100%. The sensitivity can be increased to over 85% when an intermediary complement step is performed: first the sample, then AB serum as complement source, followed by FITC-labelled anti-C1q or -C3 or -C4. In positive cases the tissue sections then show a pronounced, streaky pattern in nearly all areas of the CNS.
A BIOCHIP Mosaic comprising frozen sections of the following primate tissues: hippocampus, cerebrum, cerebellum, peripheral and optic nerves, foetal intestine, pancreas and liver, as well as cell substrates with recombinantly expressed neuronal antigens enables appraisal of the reactions in the same test run, and, simultaneously, identification of further autoantibodies that are relevant for differential diagnostics. In many cases, this results in a fast and secure (and sometimes unexpected) life-saving diagnosis. Two starting dilutions are incubated in parallel: 1:10 and 1:100. The immunoglobulin classes IgA, IgG and IgM are investigated, optimally in separate test runs.
Which kind of specimen should be used for evaluation: serum alone or serum and CSF?
In most cases serum enables fast results, and the antibody titers are usually higher than in CSF. If the serum is negative, the CSF may yield a finding in individual cases. If a long disease course is expected, antibodies are determined in both fluids in order to establish the initial titers.
In neurology, autoimmunity is not the only focus of EUROIMMUN, a second area is neurodegenerative disorders. Please tell us about biomarkers that could be evaluated in these diseases? Are there any novel biomarkers/antibodies recently observed in patients with autoimmune encephalitis?
When it comes to Alzheimer’s disease, the following parameters are now investigated routinely: amyloid pathology can be measured with beta-amyloids (1–40) and (1–42), while in tau pathology total tau and phosphorylated tau proteins are analysed in CSF samples.
Together, these markers can give quite a clear picture of whether Alzheimer’s disease or some other dementia type is present in the patient.
Other neuronal integrity and synaptic markers like BACE-1 (beta-secretase 1) or neurogranin in Alzheimer’s disease are still being researched to understand the whole pathology and progress of the disease.
In other neurodegenerative disorders, different markers can be helpful, for example, alpha-synuclein in Parkinson’s disease or neurofilaments in the diagnosis of amyotrophic lateral sclerosis or in multiple sclerosis treatment follow-ups.
Tau proteins and neurofilaments also play an important role after traumatic brain injury, giving feedback on the severity of the possible brain damage.
Are Alzheimer’s disease diagnostics performed routinely in German patients with mild symptoms?
For supporting the diagnosis of Alzheimer’s disease, the measurement of amyloids and tau proteins has already been incorporated into diagnostic guidelines and our main customers in Germany are already general labs.
Doctors and patients are becoming increasingly aware about the disease “dementia” and the possibility of obtaining an early risk assessment for developing such a disease.
Therefore, increasing numbers of patients in an early phase of mild cognitive impairment are already requesting such an analysis.
What about treatment of Alzheimer’s disease? Do you have any news from the pharma industry?
There are several anti-amyloid treatment drugs in phase 3 trials. In addition, anti-tau treatment and BACE inhibitors are new targets for possible drugs.
All big pharma companies are working hard on possible treatments, but at the moment no treatment is actually available. However, it is only a matter of time before there is a breakthrough. Patients should train their brains and learn languages or poems.
Thank you for the interview.
Interviewer: Małgorzata Klimczak-Filippowicz

Małgorzata Klimczak-Filippowicz
Dyrektor Działu Sprzedaży i Marketingu







Dodaj komentarz